방사선 치료
뇌출혈 뇌경색 건강정보는
[ 간병 투게더 ]
1. 정위적 방사선 수술(stereotactic radiosurgery)의 개념
먼저 ‘방사선 수술(radiosurgery)’은 에너지를 전파하는 물질 또는 방식의 하나인 방사선을 이용하여 종양(이외에도 많은 질병의 치료에 적용할 수 있지만, 구체적인 적응증은 아래에서 따로 다루겠습니다. 여기에서는 이해를 돕기 위해 종양으로 국한해서 설명하겠습니다.)을 치료한다는 점에서 ‘방사선 치료(radiotherapy)’의 일종으로 볼 수 있습니다. 하지만, 일반적으로 방사선 치료라고 하면, ‘통상적인 방사선 치료(conventional radiotherapy)’를 말하는 것으로 ‘방사선 수술’과는 그 치료 방법에서 큰 차이가 있습니다.
‘통상적인 방사선 치료’는 치료의 목표(방사선 치료의 주된 목표가 되는 부위를, 일반적으로는 타겟이라고 합니다.)가 되는 종양에 대한 치료 효과를 높이고, 방사선에 노출된 정상 조직의 부작용을 최소화하기 위해, 낮은 선량의 방사선(low dose radiation)을 여러 번에 걸쳐 나누어(multiple fraction) 조사(irradiation)하는 방법을 이용합니다. 이를 분할(fractionation)이라고 합니다. 따라서, 악성 종양인 암에 대한 ‘통상적인 방사선 치료’는 1주일에 5회씩 방사선 치료를 시행하는 방식을 5~8주에 걸쳐 시행하게 됩니다.
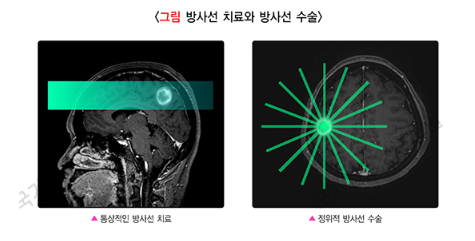
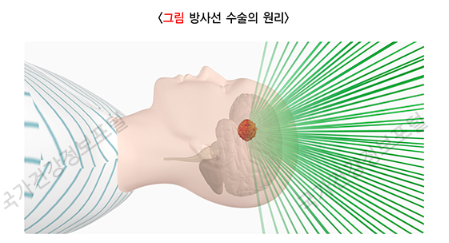
하지만, ‘방사선 수술’은 높은 선량의 방사선(high dose radiation)을 1회, 한 번(single fraction) 조사하여, 하루에 치료가 끝난다는 점에서 ‘통상적인 방사선 치료’와 차이가 있습니다. 돋보기를 이용하여 햇빛을 한곳에 집중하여, 불을 만들 수 있을 정도의 높은 에너지를 얻는 것과 같은 방식으로, 낮은 선량의 방사선들이 여러 방향에서 종양에 집중되도록 합니다. 또한, 방사선이 집중되는 종양에는 높은 방사선량을 조사하고, 주변 정상 조직에 대한 방사선의 영향은 최소화할 수 있도록 고안된 치료 방법입니다.
방사선을 이용하여 수술적 절제술(surgical resection, 종양을 수술적으로 제거하는 방법)과 유사한 효과를 얻을 수 있다는 의미에서, 방사선 수술이라는 이름을 붙인 것으로 알려져 있습니다. 그러나, 수술적 절제술처럼 치료 후 종양을 바로 없앨 수 있는 것은 아니며, 종양에 대한 치료 효과가 장기적으로 수술적 절제술과 비슷하다는 의미로 이해해야 합니다.
따라서, 1회를 초과하여 방사선 치료가 시행이 된다면, 개념적으로는 ‘통상적인 방사선 치료’의 영역에 포함되는 것으로 봐야합니다. 하지만, 1950년대 초에 ‘방사선 수술’ 기법이 고안되어, 1970년대와 1980년대를 거치면서, ‘방사선 수술’의 치료 효과가 우수한 것이 알려지면서, 기존의 ‘통상적인 방사선 치료’ 기법에서 분할 횟수를 줄이고, 치료 당 방사선량(fractionation size 또는 dose per fractionation)을 늘리거나, ‘방사선 수술’에 분할의 개념을 접목하여, 종양에 대한 치료 효과를 올리고, 정상 조직에 대한 부작용을 줄이려는 시도를 하게 되었습니다. 그 결과, 3~5회에 걸쳐 나누어 치료하는 방식의 방사선 치료가 최근 많아지고 있는데, 이는 낮은 선량의 방사선을 일반적으로 수십회에 걸쳐 나누어 조사하는 방식의 ‘통상적인 방사선 치료’ 보다는, 상대적으로 높은 선량의 방사선을 단기간에 조사한다는 의미에서 ‘방사선 수술’쪽에 더 가까운 치료 개념으로 받아들여지고 있어, 넓은 의미의 ‘방사선 수술’에 포함시키고 있는 경향입니다.
여기서, ‘정위(定位; stereotactic)’라는 말은 ‘위치를 정한다.’라는 뜻으로, 3차원 공간인 인체에 외부 또는 내부의 기준점(indicator)을 이용하여 좌표를 설정함으로써, 치료 목표인 종양의 정확한 위치를 좌표로 변환하게 되는 일련의 과정을 말합니다. 이를 통해, ‘방사선 수술’ 장비에서 좌표로 변환된 종양의 정확한 위치에 방사선을 조사할 수 있게 됩니다. ‘방사선 수술’이 일반적으로 종양에 좌표를 설정하는 ‘정위(定位)’의 과정을 거쳐 치료가 진행되므로, ‘정위적 방사선 수술(stereotactic radiosurgery)’이라고 부르는 것이 정확한 표현이지만, 편의상 ‘방사선 수술’이라고 줄여서 부르기도 합니다.
2. 감마나이프 방사선수술의 역사
스웨덴의 신경외과 의사인 라스 렉셀(Lars Leksell)은 1951년에 한 편의 논문을 발표합니다. 이 논문에서 그는 머리에 반원 형태의 틀을 고정하고, 그 틀에 X-선(X-ray) 발생 장치를 연결하는 방식으로 뇌 질환이나 종양을 치료하는 방법의 가능성을 소개하는 것이었습니다. 그 틀을 앞뒤로 회전시키고, 엑스선 발생 장치를 틀을 따라 좌우로 이동시키면, 머리의 어느 방향에서나 원하는 뇌의 목표 부위에 방사선을 전달할 수 있었습니다.
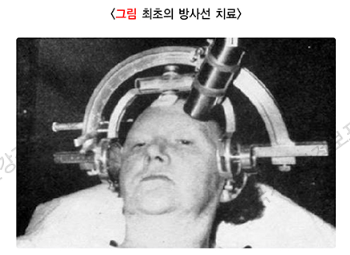
이 방식은 기존에 머리의 피부와 머리 뼈를 절개한 후, 바늘 형태의 전극을 뇌의 특정 목표(주로는 시상)에 위치시키고, 전극을 통해 그 목표 부위에 전류가 흐르도록 하여 뇌 조직을 부분적으로 파괴함으로써, 수전증 등을 치료하던 ‘기능 신경외과 수술(functional neurosurgery)’을 ‘방사선 수술’로 대체할 가능성을 보여주는 것이었습니다. 즉, 머리를 열지 않고, 방사선이라는 에너지를 뇌에 직접 전달하는 방식으로 원하는 뇌 조직을 부분적으로 파괴할 수 있을 뿐만 아니라, 이런 방식을 반복함으로써 뇌종양에 대해서는 기존의 방사선 치료는 물론 수술적 절제(surgical resection)에 준하는 효과를 얻을 수 있을 것으로 기대하였습니다. 이 부분에서 ‘방사선 수술’이 ‘통상적인 방사선 치료’와 달리 한 번에(single fraction) 높은 방사선량을 조사하게 된 이유를 알 수 있습니다. 이를 이해하기 위해서는 방사선 생물학(radiobiology)을 알아야 하는데, 여기에서는 간단히 소개만 하겠습니다.
성장을 매우 빠르게 하는 악성 종양의 경우에는 종양 세포를 방사선을 이용하여 치료하는데, 낮은 방사선량을 여러 번 나누어(multiple fraction) 주는 것이 더 효과적이지만, 정상 뇌조직으로 구성되어있고 기능에 이상이 발생한 뇌의 특정 부위를 방사선을 이용하여 파괴하기 위해서는 한 번에 매우 높은 방사선량을 이용하는 것이 더 효과적이었기 때문입니다. 따라서, 방사선을 이용해서 정상 뇌 조직의 일부를 파괴하는 것을 기본적인 목표로 한 것이 ‘방사선 수술’이었기에, ‘통상적인 방사선 치료’와는 완전히 다른 방식을 적용할 수밖에 없었던 것입니다.
머리의 피부와 머리 뼈를 통과하여, 뇌의 깊은 곳에도 충분한 에너지를 전달하기 위해서는 당시의 기술로는 초음파나 X-선으로는 그 목적을 이룰 수 없었기에, 그보다 높은 에너지를 가진 감마선(gamma ray)과 입자선(particle beam)을 이용한 실험과 치료 기구의 개발을 지속하게 됩니다. 1960년대 초에 양성자(proton)를 이용한 방사선 수술 장비가 개발이 되었으나, 양성자를 만들기 위한 입자 가속기(particle accelerator)를 병원마다 설치하는 것이 불가능하였기 때문에, 현실적으로 병원마다 설치가 가능한 간결한 형태의 방사선 발생 및 치료 장비를 개발하고자 하였습니다.
그 결과 1967년 감마나이프(Gamma Knife)라는 방사선 수술 장비의 초기 모델(prototype)을 개발하게 됩니다. 감마선이라는 방사선을 이용하여 ‘칼(knife)을 가지고 진행하는 수술적 절제’에 버금가는 효과를 낼 것으로 기대하여 감마나이프라고 이름 지었다고 합니다. 이 장비는 감마선을 방출하는 방사성 동위원소(radioactive isotope)인 코발트-60(cobalt-60)을 반구의 201곳에 고정하여 설치하고, 여기에 각각 원뿔 형태의 조준기(collimator)가 연결되어 반구의 중심(isocenter)에 201곳으로부터 나오는 감마선이 집중되는 구조를 가지고 있었습니다. 이 조준기에 환자가 치료 전에 머리에 쓰게 되는 렉셀 프레임(Leksell frame)이라는 틀을 연결하여 고정하면, 원하는 뇌의 특정 부위에 정확하게 감마선을 조사할 수 있도록 고안되었습니다.
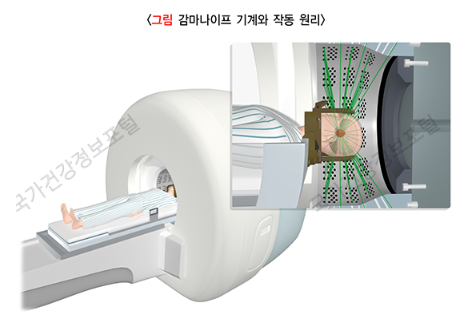
당시에는 영상 기술이 발달하지 않아, 치료 목표(target)가 되는 뇌의 특정 부위는 렉셀 프레임을 쓴 상태에서 머리뼈 X-선 영상 또는 공기뇌조영술(pneumoencephalography)을 이용하여, 그 영상 위에 틀을 기준(indicator)으로 한 좌표를 일일이 기입하는 방식을 통해 설정할 수 있었습니다.
이후 감마나이프(Gamma Knife) 방사선 수술은 각종 뇌 종양과 뇌혈관 질환 및 기능성 뇌질환(functional neurological disorder)의 치료법으로 적용되었습니다. 그 치료 결과는 실제로 매우 우수하여, 당시의 수술적 절제술에 필적하거나 그 보다 더 뛰어난 치료 성적을 보여주었습니다. 이런 상황에서 1970년대와 1980년대를 거치면서 컴퓨터 단층 촬영(computed tomography, CT)와 자기 공명 영상(magnetic resonance image, MRI)이 개발되면서, 뇌 영상 기술이 획기적으로 발전하여, 치료 목표인 뇌 종양과 뇌 구조물을 더욱 분명히 확인할 수 있게 되었으며, 감마나이프 치료 장비의 자동화 및 전산화를 통하여, 방사선 수술의 정확도를 획기적으로 개선할 수 있었습니다. 이를 통해, 감마나이프 방사선 수술의 오차 범위는 1 mm 이하로 매우 높은 정확도를 유지하면서 치료를 시행할 수 있습니다.
실제 치료 환자 사례와 학술적 연구를 통해 치료 효과의 우수성이 입증되면서, 1990년대 초 아시아와 북미 등 여러 국가에서 감마나이프를 도입하기 시작하였고, 현재에는 전세계에서 340여대의 감마나이프가 운용되고 있습니다. 세계적으로 총 누적 치료 환자수는 100만명을 넘었으며, 매년 8만명 이상의 환자들이 감마나이프 방사선 수술로 치료를 받고 있는 것으로 알려져 있습니다. 우리나라에는 1990년 감마나이프(Gamma Knife®)가 처음 도입되었고, 현재에는 20개의 병원에서 감마나이프 방사선 수술을 시행하고 있습니다.
감마나이프 장비(Gamma Knife unit)은 1990년대와 2000년대 지속적으로 자동화를 기반으로 한 업그레이드가 진행되며, 새로운 모델이 지속적으로 개발되었습니다. 현재에는 192개의 코발트-60 을 가지는 원뿔 형태의 조준기(collimator)로 변형되었으며, 환자들에게 치료 과정에서 가장 큰 불편감의 원인이 되었던, 렉셀 프레임을 머리 뼈에 고정하지 않고도 치료를 진행할 수 있는 형태인 ‘Gamma Knife ICON®’이 최신 모델로 개발되어 있습니다.
이런 역사적 배경으로, 감마나이프(Gamma Knife®)가 방사선 수술의 대명사처럼 받아들여지고 있지만, 감마나이프 방사선 수술의 성공을 계기로, 이와 유사한 방사선 치료를 시행할 수 있는 장비들이 1990년대에 개발되었고, 사이버나이프(Cyberknife®)와 노발리스(Novalis®) 등의 장비도 방사선 수술을 시행할 수 있습니다.
[치료의 적응증]
감마나이프 방사선 수술의 적응증
일반적으로, 감마나이프 방사선 수술은 머리 부분과 일부 상부 경추까지 감마선이 닿을 수 있는 부위에 위치한 대부분의 종양이나 뇌혈관 질환에 적용을 할 수 있습니다. 하지만, 각 종양의 방사선에 대한 특성이나 주변 뇌신경 등 주요 구조물과의 상대적인 위치 관계 등에 따라 수술적 절제(surgical resection), 통상적인 방사선 치료(conventional radiotherapy) 등을 함께 고려하여, 어떤 치료가 더 효과적일지 잘 판단하는 것이 중요합니다.
감마나이프 방사선 수술은 대부분의 경우 전신마취를 필요로 하지 않고, 치료 시간이 대체로 2~3시간 미만으로 짧아, 고령의 환자에서 내과적 문제로 인해 전신마취의 위험성이 높거나, 수술적 절제가 어려운 경우에도 안전하게 치료할 수 있는 방법입니다. 감마나이프 방사선 수술은 치료 목표인 종양이나 뇌혈관 기형의 크기가 작을수록 그 효과가 매우 뛰어납니다. 충분한 방사선량을 조사(irradiation)할 수 있으면서, 주변 정상 뇌조직에 대한 방사선의 영향을 최소화할 수 있기 때문입니다. 따라서, 대체로 직경이 3 cm 미만인 종양이나 뇌혈관 기형을 감마나이프 방사선 수술의 좋은 적응증으로 생각합니다. 이는 직경 3 cm를 초과하는 경우, 그 주변 정상 뇌조직이 받는 방사선의 영향이 불가피하게 많아져, 뇌부종 등의 부작용 발생의 가능성이 높아지기 때문입니다. 하지만, 최근에는 3~5회 분할(fractionation) 치료의 개념을 적용하여, 치료 목표의 크기가 3 cm를 초과하더라도, 이런 부작용의 발생을 최소화하려는 시도가 이루어지고 있고, 좋은 결과를 보이고 있습니다.
그렇지만, 대부분의 경우에 종양의 크기가 3 cm를 초과하면서 신경학적 이상을 이미 초래하고 있다면, 종양을 수술적으로 제거하는 것을 우선적인 치료로 생각합니다. 수술적으로 제거한 이후, 남은 잔존 종양에 대해 감마나이프 방사선 수술을 시행하는, 복합요법(multimodal treatment)의 경우 크기의 제한으로 인해 감마나이프 방사선 수술의 위험성이 높은 경우, 매우 이상적이며 효과적인 치료 방법으로 인정되고 있습니다. 적응 질환을 자세히 분류하면 아래와 같습니다.
1. 양성 종양
① 뇌수막종(meningioma), 신경초종(schwannoma), 뇌하수체 종양(pituitary tumor), 양성 신경교종(benign glial tumor), 두개인두종(craniopharyngioma), 혈관아세포종(hemangioblastoma), 송과체 종양(pineal gland tumor), 신경섬유종증(neurofibromatosis), 맥락총유두종(choroid plexus tumor), 신경절세포종(gangliocytoma) 등의 거의 모든 양성 뇌종양
② 눈, 코, 귀, 안면, 목 등 두경부 부위의 양성 종양
2. 악성 종양
① 전이성 뇌종양(metastatic brain tumor), 악성 신경교종(malignant glial tumor), 수모세포종(medulloblastoma), 원시신경외배엽성 종양(primitive neuroectodermal tumor; PNET) 등의 배아성 종양(embryonal tumor), 연골육종(chondrosarcoma), 척삭종(chordoma) 등의 악성 뇌종양
② 포도막 흑색종(uveal melanoma), 측두골이나 비인두부, 코 및 부비동, 침샘에 생긴 종양 등의 두경부 부위의 악성 종양
3. 뇌혈관 질환
① 뇌동정맥 기형(arteriovenous malformation)
② 해면상혈관종(cavernous malformation)
③ 동정맥루(arteriovenous fistula)
4. 기능성 뇌 질환
① 파킨슨병(Parkinson’s disease), 손 떨림(essential tremor), 이긴장증(dystonia) 등의 운동장애 질환(movement disorder)
② 삼차신경통(trigeminal neuralgia), 군발성 두통(cluster headache), 암성 통증(cancer pain), 뇌졸중 후 통증(poststroke thalamic pain) 등의 불인성 통증(intractable pain)
③ 뇌전증(epilepsy)
④ 강박장애(obsessive-compulsive disorder), 난치성 불안증(refractory anxiety disorder) 등의 정신질환(psychiatric disease)
5. 안질환
① 포도막 흑색종(uveal melanoma)
② 맥락막 혈관종(choroidal hemangioma)
③ 연령과 관련된 각막반 퇴행증(age-related macular degeneration)
④ 진행된 녹내장(advanced glaucoma)
6. 척추 질환
상부 종양 및 경추부 혈관 질환
[치료 방법]
1. 감마나이프 방사선 수술 치료 과정
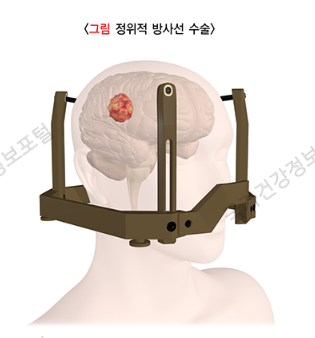
1) 정위기구 고정
3차원 공간인 뇌의 각 부위에 좌표를 설정하여, 치료 목표의 위치를 정확히 설정하기 위하여, 렉셀 프레임(그림)이라는 티타늄으로 만들어진 틀을 머리에 고정하게 됩니다. 이마와 후두부의 각 2곳에 국소마취 이후 틀을 고정하게 되는데, 이 과정에서 불편감을 느낄 수 있습니다. 국소마취를 하는 과정에서는 주사 부위에 가벼운 통증을 느낄 수 있으며, 틀을 고정하는 과정에서는 통증보다는 강한 압박감을 느낀다고 합니다.
최신 모델인 감마나이프 아이콘(Gamma Knife ICON®)은 그물 형태의 안면 마스크로 머리를 고정하여 치료를 진행할 수 있어, 정위기구를 고정하는 과정에서 발생하는 불편감을 없앨 수 있습니다. 하지만, 치료 대상의 종류와 방사선량 등 치료 내용에 따라, 안면 마스크는 제한적으로 적용되는 실정입니다.
2) 영상 촬영
렉셀 프레임이 머리에 고정된 상태에서 기준틀(indicator)을 프레임에 장착한 이후 CT 또는 MRI를 촬영하게 됩니다. 영상 촬영은 MRI의 경우 보통 30분 정도의 시간이 소요됩니다. 촬영된 영상은 감마나이프 방사선 수술의 치료 계획을 위한 소프트웨어인 감마플랜(Gamma Plan®)이라는 소프트웨어가 탑재된 워크스테이션으로 전송되어 치료 계획을 세우는 기본 자료로 이용됩니다. 치료 대상에 따라 뇌혈관조영술 영상이나 CT 영상을 추가로 시행하여, MRI와 이들 영상을 병합하여 치료 목표(target) 설정과 정확도를 높이기 위한 자료로 활용됩니다.
3) 치료 계획
감마플랜(Gamma Plan®)으로 전송된 영상을 3차원적으로 재구성하여 종양 등의 치료 목표를 정확히 설정합니다. 이후 치료 목표 주변의 정상 뇌조직의 방사선 영향을 최소화하면서, 방사선이 조사(irradiation)되는 방향, 범위, 방사선량을 결정하게 됩니다. 이에 따라, 치료 목표에 대한 치료 효과를 증대하거나, 주변 정상 뇌조직의 방사선 영향을 최소화하기 위해 1회 치료(single fraction)를 시행할지 또는 3~5회에 걸쳐 나누어 치료할지를 결정하게 됩니다.
4) 감마나이프 방사선수술 치료 진행
감마플랜(Gamma Plan®)에서 감마나이프 치료기로 계획한 치료 내용이 전송되면, 감마나이프 치료기에 누워서 치료를 받게 됩니다. 치료 중에는 특별한 통증이나 소음은 없습니다. 치료 내용에 따라 짧게는 20~30분, 길게는 2~3시간이 걸릴 수 있습니다. 치료 중에는 의료진은 모니터를 통하여 환자의 상태를 면밀히 살필 수 있고, 치료기에 설치된 마이크를 통하여 환자는 의료진과 항상 대화할 수 있습니다. 필요에 따라서는, 중간에 치료를 중단하였다가 휴식을 취한 후, 남은 치료를 연결해서 시행할 수도 있습니다.
대부분의 환자에서 특별한 진정제나 전신마취 등의 조치 없이 치료를 끝낼 수 있지만, 소아청소년이나 심한 폐쇄공포가 있는 경우에는 진정 치료를 시행하거나, 전신마취가 필요한 경우도 있습니다.
5) 정위기구 제거
치료가 끝나면, 바로 머리에 고정된 렉셀 프레임을 제거합니다. 이후, 고정 부위의 출혈 여부를 확인하고, 소독을 시행한 후 밴드를 붙입니다. 고정 부위는 흉터가 대부분 남지 않고, 치료 후 2~3일이면 샤워를 하거나 머리를 감을 수 있습니다.
6) 퇴원
감마나이프 방사선수술은 당일 또는 1박 2일로 대부분 진행됩니다. 따라서, 치료가 끝나면 대체로 당일 퇴원하게 됩니다.
2. 각 질환별 감마나이프 방사선 수술
1) 뇌수막종(Meningioma)
뇌수막종은 두개강 내 종양의 30%를 차지하는 흔한 종양 중 하나입니다. 대부분이 느리게 자라고, 두개골 외로 전이하지 않는 생물학적 양성 종양이나, 상당한 크기로 자라 주변 뇌와 신경, 혈관 등에 여러 영향을 줄 수 있습니다. 또한 크기가 작다고 할지라도 뇌 심부에 발생한 경우에는 뇌신경을 압박하여 다양한 증상을 유발할 수 있습니다. 뇌수막종은 환자의 연령 및 전신상태, 증상의 정도, 종양의 크기와 위치, 수술에 따르는 위험성과 합병증을 고려하여 적절한 치료법을 선택하게 됩니다. 지금까지는 종양의 즉각적 제거 및 종괴 감압에 의한 증상 완화, 조직학적 확진이 가능한 수술적 제거가 치료의 핵심으로 시도되어 왔습니다.
그러나 고령 및 전신질환 등으로 인해 수술 후 합병증이 예견되는 경우는 수술이 적합하지 못합니다. 또한 뇌 심부에 있거나 주변 구조물로 인해 완전 절제가 어렵거나, 이러한 구조물 손상으로 심각한 후유증이 예상되는 경우 수술이 어려울 수 있습니다. 이렇게 수술 후 합병증이 예견되는 수막종에 대하여 감마나이프 방사선 수술은 일차적/대체적 치료로 사용될 수 있습니다. 또한 불완전 절제, 혹은 재발한 수막종, 고등급 수막종에 대한 보조적 치료로도 사용될 수 있습니다. 현재까지 보고된 수막종에 대한 방사선 수술의 결과는, 수술을 대신하는 일차적 치료로, 종양의 성장이 억제되거나 줄어드는 경우가 5년에 86~100%, 10년은 83~95%로 매우 높습니다. 다기관 연구를 통해, 10년간 장기 추적관찰 결과 6.6%의 영구적 합병증이 발생할 수 있다고 보고되었고 수개월에서 수년에 걸쳐 발생한다고 알려져 있습니다. 또한 수술 후 잔존 종양에 감마나이프를 시행할 경우, 15년 종양 조절율이 87%까지 보고되었습니다. 잔존 종양이 남았을 때 감마나이프를 시행하지 않을 경우 15년 종양 조절율이 30%로 보고된 것에 비하면 감마나이프는 잔존 종양에 대하여도 효과적인 보조적 치료로서의 역할을 하고있는 것을 확인할 수 있습니다. 이렇게 뇌수막종에 대한 감마나이프 방사선 수술은 합병증의 가능성과 정도가 낮은 안전한 방법이면서도, 10년 치료 성적을 보면 미세 수술적 치료에 못지 않은 좋은 결과를 보이고있는 효과적인 치료 방법입니다.
2) 청신경초종(Acoustic neuroma, Vestibular schwannoma)
신경초종은 신경의 가장 바깥층에서 신경섬유를 보호하는 막인 신경초에서 발생한 종양으로, 드물게 악성 신경초종이 있기는 하지만 일반적으로 양성 종양으로 알려져 있습니다. 다른 뇌신경에서도 발생할 수 있지만 청력을 담당하는 청신경에서 생기는 경우가 가장 많으며 이를 청신경초종이라고 합니다. 많은 환자분이 귀가 울리는 이명 증상, 어지러움증, 청력 감소를 호소하여 병원을 방문하게 됩니다.
종양의 크기와 수술 전 청력 상태는 청신경초종의 치료를 결정하는데 중요한 요인입니다. 청신경초종의 치료 방법에는 보존적인 치료, 수술적 치료, 감마나이프 방사선 수술 치료가 주로 사용되고 있습니다. 수술적 치료는 가장 오래된 방법으로 20세기 후반까지는 주된 치료법으로 자리잡았으나 최근 치료 방법의 선택에 있어 많은 변화가 이루어지고 있습니다. 청신경초종에 대한 방사선 수술은 1969년 Leksell에 의해 처음 시행되었고, 이후 방사선 수술에 대한 급격한 경험 증가 및 좋은 성적으로 청신경초종이 감마나이프에 좋은 적응증으로 알려지면서 전 세계 많은 환자들이 현재 감마나이프 방사선 수술을 받고 있습니다. 청신경 초종에 대한 감마나이프 수술의 치료 성공율은 약 96~99%에 이릅니다. 5년 이상 추적관찰 하였을 때 91~97%가량, 10년 이상 추적관찰하였을 때도 96%로 종양이 억제되거나 줄어드는 좋은 치료 결과를 보이고 있습니다. 이러한 종양 조절율은 청신경초종이 자연경과상 연간 0.4~2 mm 정도 성장한다고 알려진 것과 비교해 보았을 때 감마나이프 방사선 수술이 종양의 장기적 조절 측면에서 매우 효과적인 치료임을 확인할 수 있습니다.
청신경초종의 경우 감마나이프 수술 후 상당 수에서 종양 내부가 괴사되어 일시적으로 종양 크기가 증가하며 청력 감소 등의 증상을 일으키는 것으로 알려져 있습니다. 하지만 이는 점차 크기가 감소하여 증상이 좋아지는 경과를 보이게 되며 수술이 필요한 경우는 2% 미만으로 알려져 있습니다. 감마나이프 방사선 수술은 병변의 크기, 수술 전 청력의 상태에 따라 차이가 있으나 방사선 수술 전 청력이 유지되거나, 사회적응청력(serviceable hearing)이 남을 가능성이 약 50% 정도로 보고됩니다. 또한 수술에 비해 높은 안면신경 보존율을 가지며, 뇌신경 기능저하, 뇌부종 등이 발생할 수 있으나 합병증 발생 빈도가 미세 수술에 비해 현저히 낮은 것으로 보고되고 있습니다. 감마나이프 방사선 수술 후 약 2~3개월부터 안면신경 기능 부전에 따른 일시적인 안면 마비나 삼차신경 기능부전에 따른 감각 이상이 1~2%에서 드물게 발생할 수 있습니다. 이렇듯 청신경초종에서 감마나이프 방사선 수술은 훌륭한 종양 조절율과 낮은 합병증율을 보이고 있습니다. 과거의 난제였던 거대 청신경초종의 경우에도, 안전하게 의도된 아전절제술 후 감마나이프를 추가하여 낮은 합병증율로 안정된 종양 조절이 가능하게 되었습니다.
3. 전이성 뇌종양(brain metastasis)
전이성 뇌종양은 두개강 내에 발생하는 종양 중 가장 흔한 종양 중 하나로, 암환자의 전반적인 생존기간이 증가하면서 전이성 뇌종양 환자들 역시 증가하는 추세입니다. 전이성 뇌종양은 몸의 타 장기에서 생긴 암이 뇌로 전이되어 발생한 것으로, 과거 치료하지 않을 경우 뇌압 상승 등으로 인하여 평균 4~6주 정도밖에 생존하지 못한다고 알려져 있었습니다. 그러나 방사선 치료 및 복합 요법을 통해서 생존기간이 9~12개월까지 증가하였습니다.
감마나이프 방사선 수술은 최근 20여년간 전이성 뇌종양의 치료에 있어 비약적으로 발전한 분야입니다. 방사선 수술 장비가 지속적으로 발전하면서, 치료 시간이 단축되었고, 치료의 정확성과 수월성이 개선되면서, 두개내 종양(intracranial tumor)에만 적용되던 정위적 방사선 수술의 개념이 체부 종양으로 그 치료 개념 및 기술이 확장되고 있습니다. 정위적 방사선 수술 단독 치료만으로도 수술적 제거 후 전뇌 방사선 치료를 시행한 환자군과 유사한 생존율 향상 효과를 보여, 전이성 뇌종양의 크기가 크지 않고, 개수가 제한적인 경우(통상적으로 4~5개 미만)에는 정위적 방사선 수술 단독 치료가 보편적으로 시행되고 있습니다. 하지만, 최근 4~5개를 초과하여 전이성 뇌종양 개수가 5~10개인 경우에도 정위적 방사선 수술 단독 치료만으로 2~4개인 경우와 유사한 치료 효과를 얻을 수 있는 것으로 보고되었습니다.
전이성 뇌종양이 정위적 방사선 수술에 적합한 이유는 1) 대체로 병소가 둥글며, 2) 크기가 작고 (직경 3 cm 이하), 3) 정상 뇌는 종양에 의해 전위되어 정상 뇌에 대한 방사선의 영향이 적고, 4) 경계가 뚜렷하고 주위 조직으로의 침습이 적기 때문입니다. 정위적 방사선 수술은 개두술을 통한 수술적 제거에 비해 비침습적이며, 대부분 1회의 치료로 종결되고, 전신 항암치료의 일정을 지연시킬 필요가 없다는 점을 장점으로 들 수 있습니다. 그리고, 인지기능 저하의 발생 가능성이 전뇌 방사선 치료에 비해 현저히 낮다는 중요한 장점이 있습니다. 최근에는 분할 치료의 개념을 적용하여, 직경 3 cm 이상의 비교적 큰 전이성 뇌종양에 대해서도 ‘정위적 방사선 수술 분할요법(hypofractionated stereotactic radiosurgery)’을 시행하여 정상 뇌조직에 미치는 방사선의 부작용 가능성을 낮추면서도, 효과적으로 종양을 치료할 수 있다는 연구 결과들이 발표되었습니다. 이러한 분할 치료는 보통 1~2일 간격으로 2~5회에 걸쳐 이루어지나, 2~4주 간격으로 2~3회 반복치료를 시행하는 방법도 시도되고 있습니다. 방사선 수술의 결과는 원발 종양, 전이암 갯수, 크기에 따라 다양한 차이가 있으나 국소 조절율은 약 70~94%에 이르는 것으로 보고되고있습니다.
감마나이프는 전이성 뇌종양의 치료에 있어서 없어서는 안되는 매우 중요한 비침습적 치료 방법으로 자리 잡았습니다. 일반 전뇌 방사선 치료에 비해 정상 뇌세포의 손상이 적어 부작용의 확률이 낮을 뿐 아니라, 뇌에 새로운 전이가 발생할 때에도 반복적으로 여러 번 치료 할 수 있는 장점이 있고, 치료효과에 따라 편마비 등 신경학적 장애 증상의 호전에도 도움을 줄 수 있습니다. 방사선 수술을 통해 효과적으로 전이성 뇌종양을 치료한다면, 원발암에 의한 것이 아니면 생존 기간을 증가시키고 신경학적 장애 없이 삶의 질을 높일 수 있습니다.
4. 뇌하수체 선종(Pituitary adenoma)
뇌하수체 선종은 전체 원발성 뇌종양 중 10~20%를 차지하는 종양입니다. 뇌하수체 선종은 크게 뇌하수체 호르몬을 과다 분비하는 기능성 뇌하수체 선종, 비기능성 뇌하수체 선종으로 나눌 수 있습니다. 기능성 뇌하수체 선종의 경우 분비되는 호르몬에 따라 다양한 임상증상을 나타내고, 비기능성 뇌하수체 종양일 경우라도 점진적으로 성장하게 되면 시신경 압박 및 뇌하수체 압박으로 인한 뇌하수체 기능저하증이 생기기도 합니다.
뇌하수체 종양은 신경학적, 안과적, 내분비적, 방사선적 검사 결과에 따라 이를 종합하여 치료가 결정되고, 치료는 약물치료, 내시경을 이용한 수술, 방사선 수술을 고려할 수 있습니다. 이 중 뇌하수체 선종에 대한 방사선 수술은 일부 미세 선종의 경우 일차적 치료로, 또는 수술 후 잔존 종양에 대한 보조적 치료로 사용됩니다. 다른 양성 종양과 달리 뇌하수체 선종은 치료를 함에 있어서 종양 억제 뿐만이 아니라 내분비 이상에 대한 치료가 함께 이루어져야 합니다. 또한, 미세 선종의 경우 정확한 종양의 위치 선정이 어려우며, 위치상 해부학적으로 시신경 등과 같은 중요 구조물이 주위에 존재하기 때문에 과거에는 방사선 수술이 활발히 시행되지 않았습니다. 그러나 최근에 고해상도 MRI 개발과 치료계획 시스템의 발전으로 시신경을 비롯한 중요 구조물들을 정확히 확인할 수 있고, 정상 뇌하수체와의 경계를 정확하게 구별하여 방사선을 조사할 수 있게 되면서 지난 10년간 전세계적으로 많은 뇌하수체 종양에 대한 방사선 수술이 시행되어 왔습니다.
감마나이프 방사선 수술로 종양의 성장이 억제되거나 줄어들 확률은 5년 추적관찰 결과 약 94%, 10년 추적관찰 결과 약 83%로 매우 높게 보고되고 있으며 장기적 종양 조절 측면에서도 효과적인 치료임이 입증되었습니다. 최근 뇌하수체 선종에서 분할 정위적 방사선 수술로 치료시 5년 추적관찰 결과 종양의 조절율이 97%로 단일 정위적 방사선 수술보다 더 좋은 결과를 보여 이러한 방법으로도 방사선 수술이 시행되고 있습니다. 호르몬 조절 면에서는 방사선 수술을 통한 뇌하수체 선종의 호르몬 수치 정상화는 10~83%로 다양하게 보고되고 있고, 70~80% 정도 증가한 호르몬 수치가 감소한다고 알려져 있습니다. 그러나 장기적으로 많은 경우에서 종양이 잘 조절되어 영상의학적 재발이 없더라도 내분비적으로만 재발하는 경우가 있으므로 지속적 영상 검사 및 호르몬 추적 검사가 필요합니다.
뇌하수체 주변은 방사선에 민감한 시신경과 여러 중요한 뇌신경들이 가깝게 있어서 시야 장애 및 뇌신경 기능 감소가 약 2% 이하로 드물게 발생할 수 있다고 알려져 있습니다. 최근에는 시신경에 영향을 주지 않는 방사선 선량이 제안되고 있고, 또한 종양 부위만 더 정밀하고 집중적으로 조사가 가능해짐으로써 합병증은 거의 발생하지 않는 것으로 보고되고 있습니다.
5. 뇌동정맥 기형(Cerebral arteriovenous malformation)
뇌동정맥 기형은 뇌혈관의 선천성 기형 중 하나로, 동맥과 정맥 사이에 정상적으로 있어야 할 모세혈관 없이 동맥에서 정맥으로 직접 이행되는 혈관 기형입니다. 시간이 지나면서 혈관 덩어리가 점차 커지고, 또한 이로 인해 혈류량이 증가하면서 높은 동맥압이 정맥 혈관에 지속적인 영향을 미치게 되는 것입니다. 이러한 기형 혈관은 혈관벽이 매우 약하고 얇아서 출혈의 위험성이 높으며 경련을 유발하거나 병소의 위치에 따라 다양한 신경학적 증상을 유발 할 수 있습니다.
뇌동정맥 기형의 궁극적인 치료 목적은 신경학적 장애를 초래하지 않으며 병소의 완전 폐색을 초래하여 재출혈을 막는 것입니다. 치료 방법으로는 미세 수술, 색전술, 방사선 수술이 있습니다. 미세 수술을 통한 병소의 즉각적, 완전 제거가 가장 효과적인 치료법이라 할 수 있으나, 병소의 위치가 깊거나 복잡한 혈관 구조를 하고 있을 경우에는 수술에 따른 합병증 위험이 매우 높습니다. 이러한 뇌동정맥 기형에 감마나이프 방사선 수술은 탁월한 효과를 보이는 것으로 알려져 있습니다. Leksell이 1970년대 감마나이프로 뇌동정맥 기형을 치료한 이후 많은 환자들이 방사선 수술을 받아왔고 그 효과를 입증하였습니다. 감마나이프 방사선 수술 후 뇌동정맥 기형의 폐색율은 일반적으로 10년 후 85% 정도로 알려져 있으나, 병변의 크기에 따라 다른 결과를 보이고 있습니다. 특히 2 cc 이하의 작은 뇌동정맥 기형은 3년이내 폐색율이 90%까지로 보고되어 있어 방사선 수술은 크기가 작은 뇌동정맥 기형에 효과적인 치료로 자리매김하였습니다.
이러한 치료 효과가 있음에도 불구하고 방사선 수술이 갖는 장점이자 단점은 방사선이 직접적으로 혈관의 점진적 폐쇄를 유발하게 되므로 방사선 수술 후 병소가 완전히 폐색되기까지 6개월에서 4년 정도의 기간이 필요하다는 것입니다. 즉 서서히 막혀 가기 때문에 뇌 혈류의 무리한 변화없이 자연스럽게 치료가 될 수 있지만, 병소가 완전히 폐색되기 전까지는 병소에서 출혈이 발생할 여지가 있습니다. 방사선 수술 후 연간 출혈율은 1.3~8%까지 보고되고 있습니다. 치료 반응 및 합병증 발생 여부를 확인하기 위해, 시술 후 6~24개월 내 정기적으로 MRI를 시행해야 합니다. 잠복기 이후에는 추적검사로서 MRI로만 완전 폐색을 평가하기는 힘들고 혈관조영술 검사를 통해 완전 폐색을 평가해야 합니다. 감마나이프 24개월 후 MRI나 혈관조영술에서 병소의 완전 폐색이 되지 않는 경우는 위험성을 없애고 완전 폐색을 위하여 반복된 감마나이프를 시행하기도 합니다.
6. 삼차신경통(Trigeminal neuralgia)
삼차신경통은 얼굴 한쪽에 삼차신경의 하나 혹은 그 이상의 가지 분포를 따라 갑자기 발생하는 짧고, 반복적으로 찌르는 극심한 통증입니다. 얼굴 감각을 담당하는 삼차신경이 혈관, 종양 등에 의해 압박되어 발생하며, 자발적 혹은 경미한 자극에 의해서 통증이 발작적으로 시작되어 수초~수분 후 자연적으로 소실되는 반복적인 임상 경과를 보입니다.
삼차신경통의 치료에는 약물치료, 경피적 신경 파괴술, 미세혈관 감압 수술, 감마나이프 등이 있고, 그 중에서 미세혈관 감압 수술이 가장 효과적이며 재발율이 낮은 치료법으로 알려져 있습니다. 방사선 수술에 의한 삼차신경통 치료는 렉셀(Leksell)이 두명의 환자를 성공적으로 치료하며 1971년 처음 보고하였습니다. 이후 고령이거나 전신상태가 좋지 않은 환자, 항응고제를 복용 중이거나 다른 치료에 반응하지 않는 환자, 수술을 거부하는 환자들에서 대체 치료법으로 감마나이프가 고려되고 있습니다. 감마나이프를 통한 통증 완화에는 평균 1~3달 가량 걸리기때문에 그동안에는 진통제 복용을 유지하게 됩니다. 통증 완화 달성 정도에 따라 천천히 진통제를 줄일 수 있습니다. 방사선의 치료 결과는 방사선량과 위치에 따라 조금씩 다르지만, 감마나이프 시행 후 1년 추적 관찰 시 50~83%, 5년 추적 관찰 시 45~55%의 환자가 완전 또는 부분적으로 통증이 완화되는 효과를 볼 수 있다고 알려져 있습니다. 초기 통증 호전율을 77~96%로 보고되었고, 1년에서의 재발율은 약 23%, 장기 추적 결과를 보면 약 4년 이상 경과하면서 재발율은 52.2%로 상당히 재발이 빈번한 것으로 보고됩니다. 감마나이프 방사선 수술은 낮은 합병증 발생율과 시술과 관련하여 사망을 포함한 치명적 합병증이 발생하지 않는다는 장점을 가집니다. 흔한 합병증은 얼굴 감각과 관련된 부작용이 2~30% 에서 보고되나 많은 경우에서 회복됩니다. 즉 감마나이프 방사선 치료는 삼차신경통 치료에 효과가 나타날 때까지 시간이 걸리고 재발율이 높다는 단점이 있으나 안전한 치료이며 재치료가 가능하고, 초기 치료 성적이 다른 치료들에 비하여 나쁘지 않은 좋은 치료법 중 하나입니다.
7. 암성 통증(Cancer pain)
암성 통증은 현대 의학에 있어서 완전히 치유되기 힘든 영역으로 보고있습니다. 암환자의 통증 유병율은 진행성 암환자 중 60~86% 정도로 보고되고 있고, 암 치료법들이 생존율을 증가시킬 수록 많은 암 환자들이 장기적인 통증 관리에 직면하게 됩니다. 암성 통증으로 고통받는 환자들이 늘어나고 있고, 감마나이프 수술은 암성 통증을 낮은 부작용으로 즉시 조절할 수 있으며, 그 기간도 지속된다는 장점이 있습니다. 1974년 심한 암성 통증으로 고통받던 8명의 말기 유방암 환자에게 감마나이프 수술이 처음 시행되었습니다. 암성 통증 조절을 위하여 감마나이프 뇌하수체 절제술이 시행되었는데, 이는 기존의 뇌하수체 절제 수술에 비해 합병증이 현저하게 줄어들었고 효과는 비슷하다는 장점이 있었습니다. 진통제로 조절이 되지 않는 암성 통증 환자, 진통제에 반응하지만 약물 부작용 등으로 적절한 통증 조절 상태를 유지하지 못하는 환자가 일차적인 치료 고려 대상이 됩니다. 암성 통증에 대한 감마나이프 방사선 수술은 여명이 얼마 남지 않은 암 환자들에게 여생동안 통증을 조절하여 삶의 질을 개선시켜주는데 크게 기여하고 있습니다.
출처 - 국가건강포털정보
'중환자실' 카테고리의 다른 글
| [중환자실] 혈관 조영술 (0) | 2022.12.02 |
|---|---|
| [중환자실] 외상성 뇌손상 (0) | 2022.11.30 |
| [중환자실] 뇌동맥류 종류, 원인, 경과, 예후, 통계, 증상, 진단, 치료, 예방 (0) | 2022.11.30 |
| [중환자실] 뇌졸중 총정리 (뇌출혈, 뇌경색) (0) | 2022.11.30 |
| [중환자실] 뇌졸중 초기 집중 재활치료 장애 회복 통계 조사(운동기능, 인지, 언어, 일상생활동작, 보행기능 등) (0) | 2022.11.28 |




